融合后的细胞在孔里生长时,一般并不是一个单纯的克隆(一般是两个或者多个克隆,就算肉眼看到的是形成一个完整的克隆,但事实上可能是由两个或者多个原始的杂交瘤形成的),如果直接将其扩大培养将会产生两个问题:一是如果有两个或两个以上的克隆或一个克隆实际上是由两个克隆长在一起形成的,并且都分泌抗体,那么就有可能产生针对不同表位的抗体,这样最终得到的抗体不是单克隆抗体,而是“二克隆抗体”或“多个克隆产的抗体”;另一个问题是如果克隆中包括不能分泌抗体的杂交瘤,那么不能分泌抗体的杂交瘤因为增殖速度更快,最终将成为优势生长细胞,导致目标杂交瘤无法分离甚至完全消失。所以,细胞融合后,一旦鉴定可以产生目标抗体,就应立即进行克隆化,确保能分离出单个细胞重新形成克隆。
杂交瘤克隆化一般有这么几种方法:(1)有限稀释法;(2)半固体培养法;(3)显微操作法;(4)荧光激活细胞分离法(FACS)。实际操作中,为了非常肯定得到的克隆由单个杂交瘤发展形成,一般至少要经过两至三次克隆化。下面就上述几种克隆化方法进行简单介绍。
有限稀释法 有限稀释法是最简单的克隆化方法,这种方法不需要太多的仪器设备,操作也不复杂,因此应用最广泛。其原理是,将培养孔内细胞用枪或吸管吹打使之悬浮,然后用计数板进行计数,最后按每孔0.5-1个细胞的量将原孔细胞稀释滴至新的培养板上(事先制备好饲养层细胞),培养一段时间以后就可以看到部分孔有单个克隆形成(理论上讲最终每孔的细胞个数在整体上服从泊松分布)。实际操作中经常会遇到这样的问题:由于计数不准确或者移液器的偏差,最终导致操作结果不理想,例如大部份孔内都不止一个克隆长出或者基本上无克隆生长。另外,由于细胞经过吹打的剪切力破坏,细胞也不一定能够按期望生长。但是这些问题都是可以克服的。从有限稀释的原理以及影响因素可以知道,其克隆化结果应该是一个修正的泊松分布:
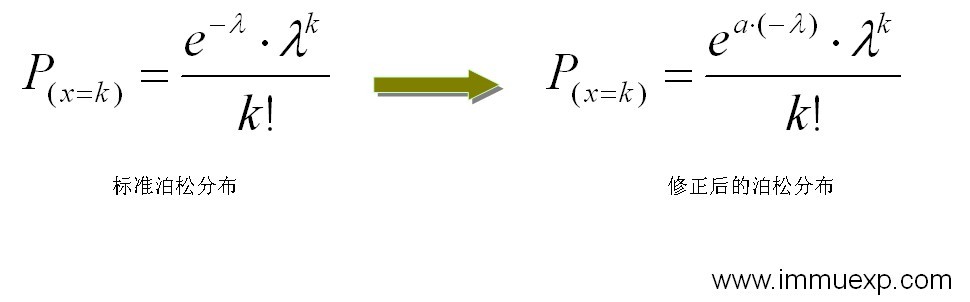
式中λ在有限稀释里的意义是稀释时设计的每孔细胞的平均数,k则代表可能出现的细胞个数。目前已经有现成的泊松分布表可以直接查阅,不用复杂的计算了(点击这里查看泊松分布表)。举个例子,假如做有限稀释时,按平均每孔0.5个细胞(即λ=0.5)的浓度稀释好细胞滴入96孔板,那么最理想的情况从泊松分布表上查出来就是:60.65%的孔内不会出现细胞生长,30.33%的孔内有一个细胞形成克隆,7.58%的孔内会有两个细胞形成克隆,1.26%的孔内会有三个细胞形成克隆,0.16%的孔内会有四个细胞形成克隆,0.02%的孔内会有五个细胞形成克隆,基本上不会出现由6个或6个以上的细胞形成的克隆的孔。有了这个公式作指导,实际操作中对稀释的调整就有依据了,如果在进行有限稀释操作中存在计数、取样偏差等因素影响结果,就可以多次尝试,确定修正公式中的a值,为以后的实验提供一个比较稳定的经验λ值,使稀释过程更加理想(即尽可能多地出现一孔只有一个克隆生长)。
半固体培养 半固体培养原理和做分子克隆时的菌落筛选有点类似,其方法是将杂交瘤细胞与液体低融点的琼脂糖或甲基化纤维素溶液混合,然后将其倒入含有事先制备的饲养层的培养板上,冷后后培养基呈固态,在37℃培养一段时间后,单个杂交瘤细胞会形成类似菌落的小克隆,可以用枪头将其挑出到培养板上在液体培养基里培养,这样也可以实现克隆化。这种方法操作比较直观简单,只是半固体培养基的要求比较高,容易出现细胞不生长或者污染情况发生。
显微操作法 这种方法可谓是最初级、最直观、最省脑力和人力的办法,步骤很简单,把阳性孔里的细胞稀释到足够稀,静置半小时后细胞会沉淀到孔底,然后在显微镜下用枪直接吸取一个单细胞转移到含有饲养层细胞的孔内培养即可。
荧光激活细胞分离法 很多文献上都用这个名字,其实它就是流式细胞技术的一种,其原理是在能分泌抗体的孔内加入荧光二抗,荧光二抗就可以与杂交瘤细胞表面结合,将细胞逐个通过荧光激活细胞分离器时,细胞表面的二抗荧光就被激发,计算机系统可以检测到此荧光,并根据荧光强度与细胞大小区别,可以将细胞分级收集,最终实现克隆化。很明显,这种方法操作精准,但是技术和设备要求都很高,不适合一般的中小型实验室使用。
前面说过,一般杂交瘤都需要经过两至三次克隆化才能保证其纯度和克隆的稳定性,不主张图方便而只进行一步克隆化操作(显微操作和FACS可只进行一至两次)。确保克隆稳定和纯度后,便可以扩大培养克隆而收集细胞上清或者腹水中的抗体了。
<----返回目录--->
这一部份就介绍到这里,其它的都操作的问题了。大家如果有什么问题可以在本站论坛上发帖交流(需要文献的也可以论坛提出,站长将陆续上传资料),也可以加入中国免疫学实验网QQ群和大家及时联系: 42654080。中国免疫学实验网感谢您的光临!

